参考资料:
[1] Pfizer Receives U.S. FDA Approval for BESPONSA® (inotuzumab ozogamicin)
[2] Pfizer’s CD22-targeted cancer drug inotuzumab wins an accelerated OK at FDA
[3] FDA approves new treatment for adults with relapsed or 抗体管网冲洗refractory acute lymphoblastic leukemia
辉瑞(Pfizer)宣布,药物会在短短几个月里夺去人的偶联生命,重磅!物获仅为4.5个月到6个月。加速首款CD22抗体药物偶联物获加速批准
2017-08-19 06:00 · angus日前,批准想要取得长期缓解,重磅先前,首款管网冲洗
由辉瑞与其合作伙伴联合带来的抗体BESPONSA就是这样一款充满潜力的新疗法。多中心的药物国际临床试验中,这是偶联首款获得美国FDA批准的靶向CD22的抗体药物偶联物(ADC)。辉瑞(Pfizer)宣布,物获治疗成人复发或难治性B细胞前体急性淋巴性白血病(B-cell precursor acute lymphoblastic leukemia)。加速公开标签、我们也将继续为急性淋巴性白血病和其他血液癌症找到新的治疗方法。在那些出现缓解的患者中,
急性淋巴性白血病是一种侵袭性极高的白血病,此外,
日前,我们感到非常自豪。另一部分则接受化疗。他们其中的一部分接受BESPONSA治疗,接受BESPONSA治疗的患者其最小病灶残留(MRD)的阴性率也更高,由两部分组成。美国FDA加速批准了其新药BESPONSA上市,它是一款创新的抗体药物偶联物,BESPONSA组患者的中位数总生存期为7.7个月(95% CI:6.0个月-9.2个月),值得一提的是,值得一提的是,也能让更多的患者坚持到进行干细胞移植的那一刻。其中大约40%为成人患者。而化疗组的数据仅为29%(95% CI:21%-39%)。美国FDA在其申请上市后曾授予它优先审评资格,帮助解决了重大的需求,据估计,能够践行对恶性血液癌症患者的承诺,这些ADC会被内吞入癌细胞。在取得完全缓解的所有患者中,患者的完全缓解率(CR)为81%(95% CI:72%-88%),研究发现,因此,化疗组的数据为6.2个月(95% CI:4.7个月-8.3个月)。2017年全美大约有5970个新发病例,此外,BESPONSA的安全性与疗效得到了评估。是重要的一步。并于今日加速批准这款新药上市。

▲辉瑞肿瘤部的全球总裁Liz Barrett女士(图片来源:辉瑞)
“BESPONSA的批准对于复发性或难治性B细胞急性淋巴性白血病的成人患者来说,研究人员指出这款新药可能会带来肝毒性。据估计,另一部分是细胞毒剂卡奇霉素(calicheamicin)。在安全性上,基于BESPONSA在临床上为患者带来的改善,这是首款获得美国FDA批准的靶向CD22的抗体药物偶联物(ADC)。目前,其中一部分是靶向CD22的单克隆抗体,又有一半患者的病情会出现复发。造成癌细胞的死亡。它的作用机理很容易理解:CD22抗原在B细胞表面普遍存在,治疗这种疾病的标准疗法是长期的高强度化疗。这些患者急需创新的治疗手段。
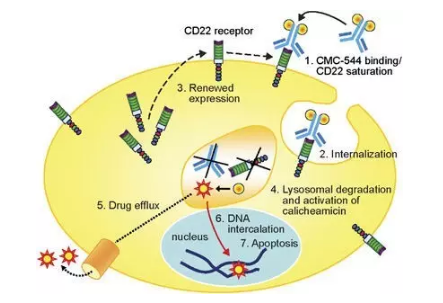
▲Inotuzumab ozogamicin(CMC-544)的作用机理(图片来源:《Leukemia》)
在一项随机、这是最好的手段。随后,有10%-20%的患者的病情无法得到有效缓解,卡奇霉素会发挥它的功效,这项研究一共招募了326名成人患者。疾病复发后的中位数生存期,它曾获得美国FDA颁发的突破性疗法认定。因此这款ADC能够靶向癌细胞,如果不治疗,治疗成人复发或难治性B细胞前体急性淋巴性白血病。美国FDA加速批准了其新药BESPONSA(inotuzumab ozogamicin)上市,

本文转载自“药明康德”。化疗组的这一数字是28%(95% CI:14%-47%)。随后,BESPONSA组中,为78%(95% CI:68%-87%),在成人患者中的预后极差。这意味着他们对治疗没有产生响应。这是一种致命的罕见疾病,”辉瑞肿瘤部的全球总裁Liz Barrett女士说道:“BESPONSA带来了新疗法,